子癇前症診斷市場展望:
2025年,子癇前症診斷市場規模為22.7億美元,預計2035年將達到60億美元,預測期內(即2026-2035年)的複合年增長率約為10.2%。 2026年,子癇前症診斷的產業規模估計為24.8億美元。

早產率的上升有望推動這一市場的成長。在孟加拉、阿富汗和中非等欠發達國家,感染、瘧疾和高青少年懷孕率是導致早產的主要原因。根據世界衛生組織的報告,2020年有1,400萬例早產,其中100萬例死於併發症。
市場的主要趨勢是伴隨診斷需求的不斷增長。隨著對了解患者需求和提供個人化醫療產品的需求日益增長,伴隨診斷的需求也隨之增長。這一趨勢將更加廣泛,預計將使包括子癇前症實驗室檢測在內的即時診斷產品進入新的市場。這進一步促進了疾病管理、患者滿意度和治療順從性的提高。所有這些因素預計將在預測期內推動先兆子癇診斷市場的成長。
關鍵 子癇前症診斷市場 市場洞察摘要:
區域亮點:
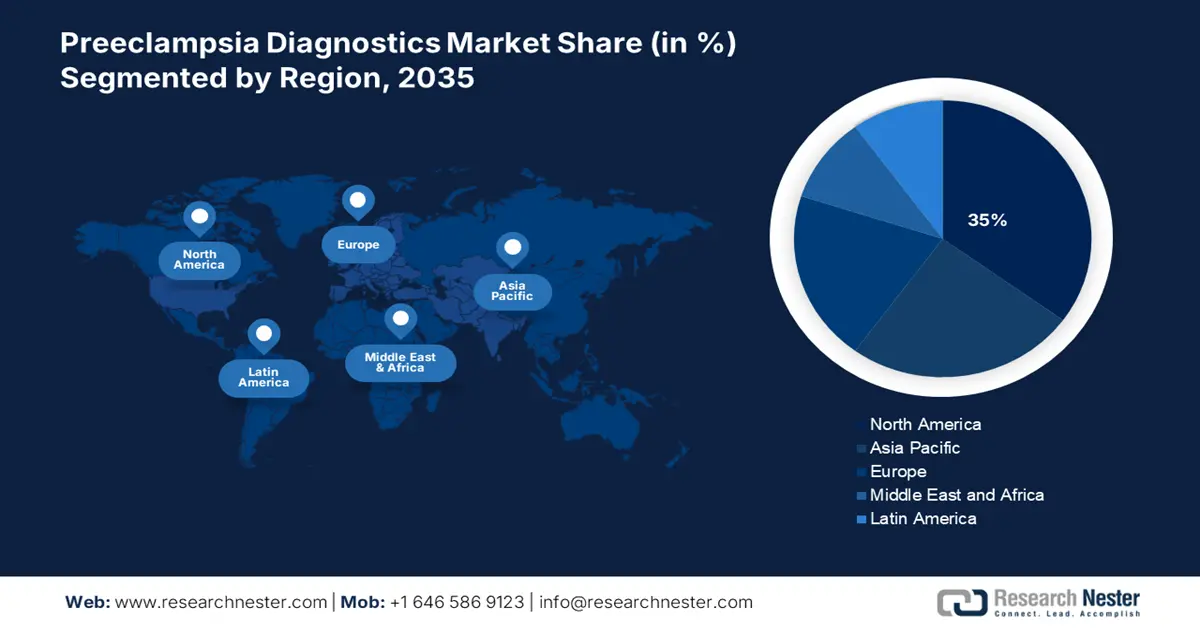
- 到 2035 年,北美子癇前症診斷市場將佔據約 35% 的份額,這得益於對藥物輸送、疫苗開發、生物技術進步以及孕產婦健康意識的關注。
- 2026 年至 2035 年期間,亞太市場將實現可觀的複合年增長率,這歸因於育齡婦女人口的增加、研究活動的不斷升級以及生物技術的進步。
細分市場洞察:
- 預計到 2035 年,先兆子癇診斷市場中的耗材細分市場將佔據 60% 的份額,這歸因於耗材成本低廉、使用量增加以及其在子癇前症診斷測試中的關鍵作用。
- 預計在 2026 年至 2035 年期間,先兆子癇診斷市場中的醫院細分市場將呈現大幅增長,這得益於醫院作為先兆子癇診斷和護理的主要中心。
主要成長趨勢:
- 新興經濟體的市場擴張
- 創新測試的開發
主要挑戰:
- 過氧乙酸的高反應性所帶來的威脅
- 缺乏對過氧乙酸各種影響的認知
主要參與者:Cardinal Health Inc.、Diabetomics Inc.、F. Hoffmann La Roche Ltd.、Thermo Fisher Inc.、Biora Therapeutics Inc.
全球 子癇前症診斷市場 市場 預測與區域展望:
市場規模與成長預測:
- 2025年市場規模: 22.7億美元
- 2026年市場規模: 24.8億美元
- 預計市場規模:到 2035 年將達到 60 億美元
- 成長預測:複合年增長率10.2%(2026-2035年)
主要區域動態:
- 最大的地區:北美(到 2035 年佔 35%)
- 成長最快的地區:亞太地區
- 主要國家:美國、德國、英國、日本、中國
- 新興國家:中國、印度、日本、韓國、巴西
Last updated on : 9 September, 2025
子癇前症診斷市場的成長動力與挑戰:
成長動力
新興經濟體的市場擴張—先兆子癇診斷市場在印度和中國等新興經濟體正在快速成長。這得益於收入成長、醫療保健可近性提升以及對子癇前症認識的提高等諸多因素。預計這些因素將在預期時間內推動先兆子癇診斷市場的成長。
創新檢測的發展-子癇前症早期診斷檢測的發展將有助於降低孕產婦和新生兒死亡率。近年來,人們對子癇前症的認識有所提高,這主要得益於患者權益組織和福利協會的宣傳。鑑於全球對子癇前症的診斷需求仍未得到滿足,這仍然是創新檢測開發帶來獲利成長機會的重要因素。
挑戰
報銷不足-預測期內,報銷不足將限制市場成長。大多數健康保險政策不涵蓋子癇前症檢測的報銷。報銷政策的缺失和高昂的費用阻礙了子癇前症檢測的普及。一些州和聯邦官員以及衛生官員已公開鼓勵保險公司審查其子癇前症診斷的保險政策。然而,市場仍缺乏子癇前症檢測的報銷服務。這些因素限制了市場的成長。因此,預計這些因素將在預測期內限制先兆子癇診斷市場的成長。
預計先兆子癇診斷的高成本將在未來一段時間內阻礙市場成長。
- 預計缺乏熟練的專業人員將限制未來的市場擴張。
子癇前症診斷市場規模及預測:
| 報告屬性 | 詳細資訊 |
|---|---|
|
基準年 |
2025 |
|
預測期 |
2026-2035 |
|
複合年增長率 |
10.2% |
|
基準年市場規模(2025年) |
22.7億美元 |
|
預測年度市場規模(2035年) |
60億美元 |
|
區域範圍 |
|
子癇前症診斷市場細分:
產品(儀器、耗材)
按產品劃分,預計2035年底,耗材領域將佔據最高的市場份額,達到60%。先兆子癇實驗室檢測的選擇和強化必須藉助耗材。子癇前症實驗室研究中使用的試劑是化學物質或混合物。耗材產業的成長受到低成本和消費頻率提高等因素的推動。市場參與者採用各種成長策略,例如推出新產品、策略聯盟和併購,以保持競爭力。市場正在鼓勵新參與者進入市場,理由是市場成長潛力適中且分銷管道暢通。
最終使用者(醫院、診所、診斷中心)
根據最終用戶情況,預計醫院細分市場在此期間將大幅成長。醫院擁有最全面的診斷服務,包括子癇前症診斷服務。醫院是孕婦接受照護的主要場所,因此最有可能診斷和管理子癇前症。此外,先兆子癇盛行率的上升預計將在預測期內推動該細分市場的成長。全球約有 2-8% 的孕婦在懷孕期間會經歷子癇前症。
我們對全球市場的深入分析包括以下幾個部分:
產品 |
|
最終用戶 |
|
測試 |
|

Vishnu Nair
全球業務發展主管根據您的需求自訂本報告 — 與我們的顧問聯繫,獲得個人化的洞察與選項。
子癇前症診斷市場區域分析:
北美市場預測
預計北美子癇前症實驗室市場在預測期內將佔據最大的市場份額,達到35%。該國市場的成長得益於多種因素,例如對 藥物輸送服務和疫苗研發的日益重視、生物技術和藥物研究的最新進展以及眾多供應商的湧現。在加拿大,透過加拿大胎兒健康監測計畫和加拿大早產兒基金會(CPBF),人們對孕產婦和胎兒保健的認識不斷提高,促使篩檢產品和子癇前症檢測在產科實驗室迅速普及。
亞太市場統計
預計2026-2035年期間,亞太地區市場將大幅成長。該市場的成長主要得益於該地區育齡婦女人口的增加。此外,該地區不斷升級的研發活動、日新月異的技術進步以及生技公司的蓬勃發展,也將推動預測期內子癇前症診斷市場的擴張。
子癇前症診斷市場參與者:
- ACON實驗室公司
- 公司概況
- 商業策略
- 主要產品
- 財務表現
- 關鍵績效指標
- 風險分析
- 近期發展
- 區域影響力
- SWOT分析
- Bio Rad實驗室公司
- BioCheck公司
- 生物梅里埃公司
- 康德樂公司
- 糖尿病學公司
- F.霍夫曼羅氏有限公司
- 賽默飛世爾科技公司
- Biora Therapeutics公司
- 希森美康公司
- 日立有限公司
- 富士生物診斷公司
- 西門子醫療股份公司
- 富士膠片公司
最新動態
- 全球科學服務領導者賽默飛世爾科技公司 (Thermo Fisher Scientific Inc.) 於 2023 年 5 月宣布,美國食品藥物管理局 (FDA) 批准了賽默飛世爾科技的 B·R·A·H·M·S PlGF plus KRYPTOR 和 B·R·A·H·M·S sFlt-H·M·STOR新型生物標記物,這是第一個也是唯一一個獲得突破性稱號並被驗證可用於先兆子癇(一種嚴重的妊娠併發症)風險評估和臨床管理的免疫測定法。
- Biora Therapeutics, Inc. 是一家重新構想治療方法的生物技術公司,該公司已達成協議,授權 Avero Diagnostics 進行先前在西北病理學公司進行的先兆子癇排除測試,以進行該產品的商業開發。
- Report ID: 4412
- Published Date: Sep 09, 2025
- Report Format: PDF, PPT
- 探索关键市场趋势和洞察的预览
- 查看样本数据表和细分分析
- 体验我们可视化数据呈现的质量
- 评估我们的报告结构和研究方法
- 一窥竞争格局分析
- 了解区域预测的呈现方式
- 评估公司概况与基准分析的深度
- 预览可执行洞察如何支持您的战略
探索真实数据和分析
常见问题 (FAQ)
子癇前症診斷市場 市场报告范围
版权所有 © 2026 Research Nester。保留所有权利。




